技術記事 -電池の基礎知識-
« 前の記事
| 技術イノベーションの源流 | ||
| 電池の歴史と基本原理 |
マクセルのマイクロ電池
マクセルは1976年に日本で初めて酸化銀ボタン電池を商品化しました。当時、日本の時計がクオーツ技術により世界を席巻していったことや、小型電卓のような小型電子機器の進化と相まって、このようなマイクロ電池のニーズは今日まで伸び続けています。
電池の種類
電池とは、正極と負極の化学物質が、それらの酸化還元反応のエネルギー変化を電気エネルギーに変換する仕組み、と言うことができます。よって、その材料の組み合わせにより、さまざまな電池が存在します。電池の歴史をたどると、古くは、1791年にガルバーニ(伊)が金属をつないだカエルの足が筋収縮を起こし、動いた現象から、(生体)電気を発見したことに始まったとも言えます。いまの化学電池の起源としては、1800年ごろにボルタが電池を発明したあと、1868年にルクランシェが、のちに乾電池の原型となるルクランシェ電池を発明したことと言われています。このように電池の歴史は非常に古いものの、いまも革新が続いている非常に珍しい技術分野とも言えます。とくに昨今の携帯電話・スマートフォン、ノートパソコンなどの電子機器、さらには電気自動車の技術革新など、昨今の世の中における技術革新を下支えしている技術の一つです。
ここでは、マクセルが長年、開発、製造、販売してきた一次電池を例に化学電池の基本的仕組みを解説します。
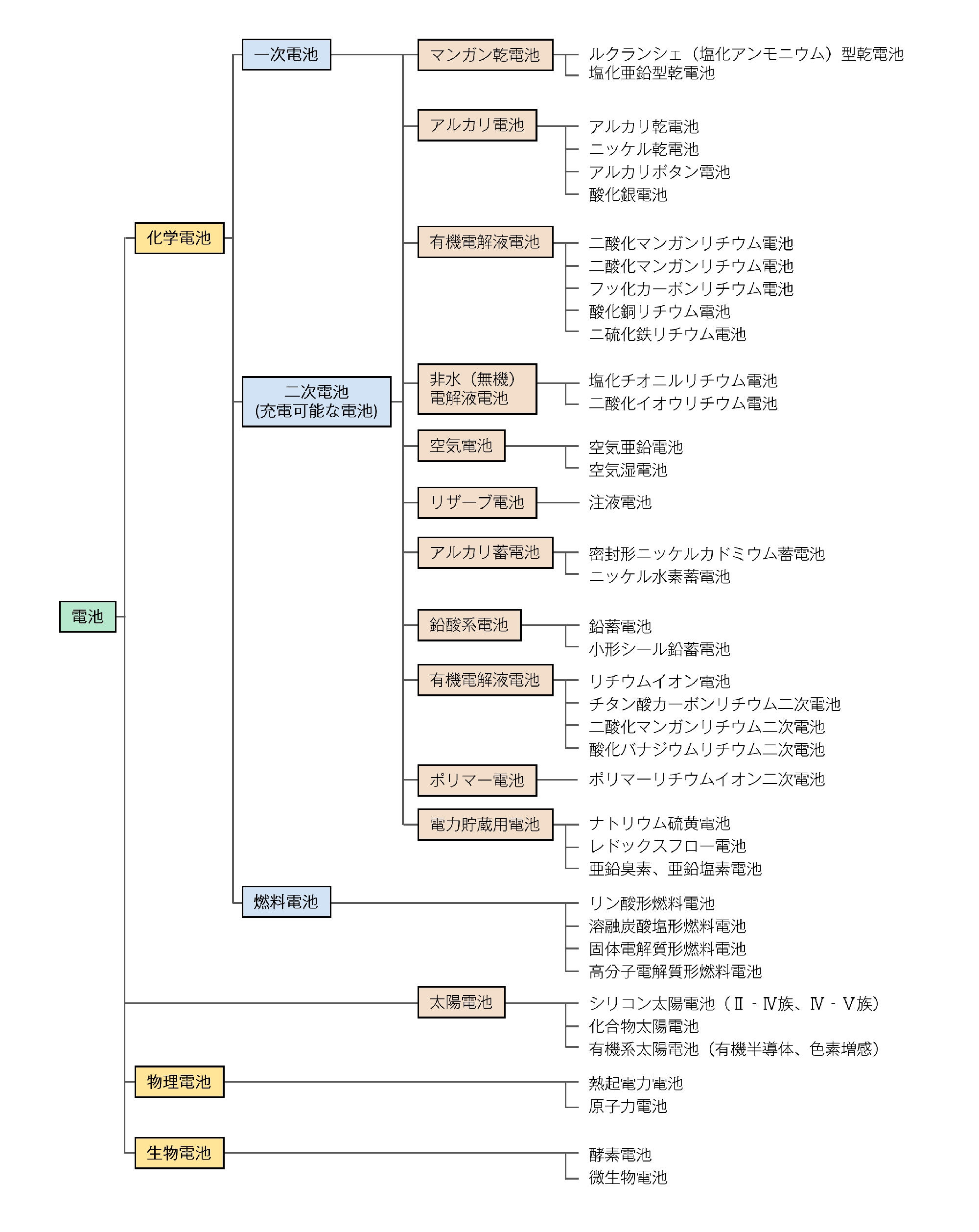
電池の種類
電池の仕組み
ここからは、もっとも一般的に使われている 化学電池(以下、電池と言う)について説明します。化学電池は、「化学物質の持っているエネルギーをその物質の化学反応によって、直接に直流の電気エネルギーに変換する発電装置」と定義することができます。ここで、その反応自体に着目すると、正極に"電子を受け取る物質 (酸化剤)"、負極に"電子を放出する物質 (還元剤)"を構成として持ち、それらの酸化還元反応によって発生した電子を外部回路に流すことが電池の機能といえます。
電池の働き:酸化還元反応によって、化学エネルギーを直接、電気エネルギーに変換する
つぎに、電池の機能の由来である、酸化還元反応について、説明します。もっとも身近な酸化還元反応のひとつは、物質の燃焼反応です。ここでは、水素の燃焼により水が生成する反応を考えてみます。
(燃焼反応における酸化還元反応)
水素の燃焼:O2(酸化剤) + 2H2(還元剤) → 2H2O(∗)
このように、水素の燃焼反応では、水素が還元剤、酸素が酸化剤として働くことになります。
ここで、水素の燃焼反応における電子の受け渡しに注目するために、同じ水素と酸素の電池での反応を見てみましょう。電池反応の場合は、電解液の中でイオンが移動することにより、正極と負極における反応が進行します。
正極(還元反応):O2 + 2H2O + 4e- → 4OH-
負極(酸化反応):2H2 + 4OH- → 4H2O + 4e-
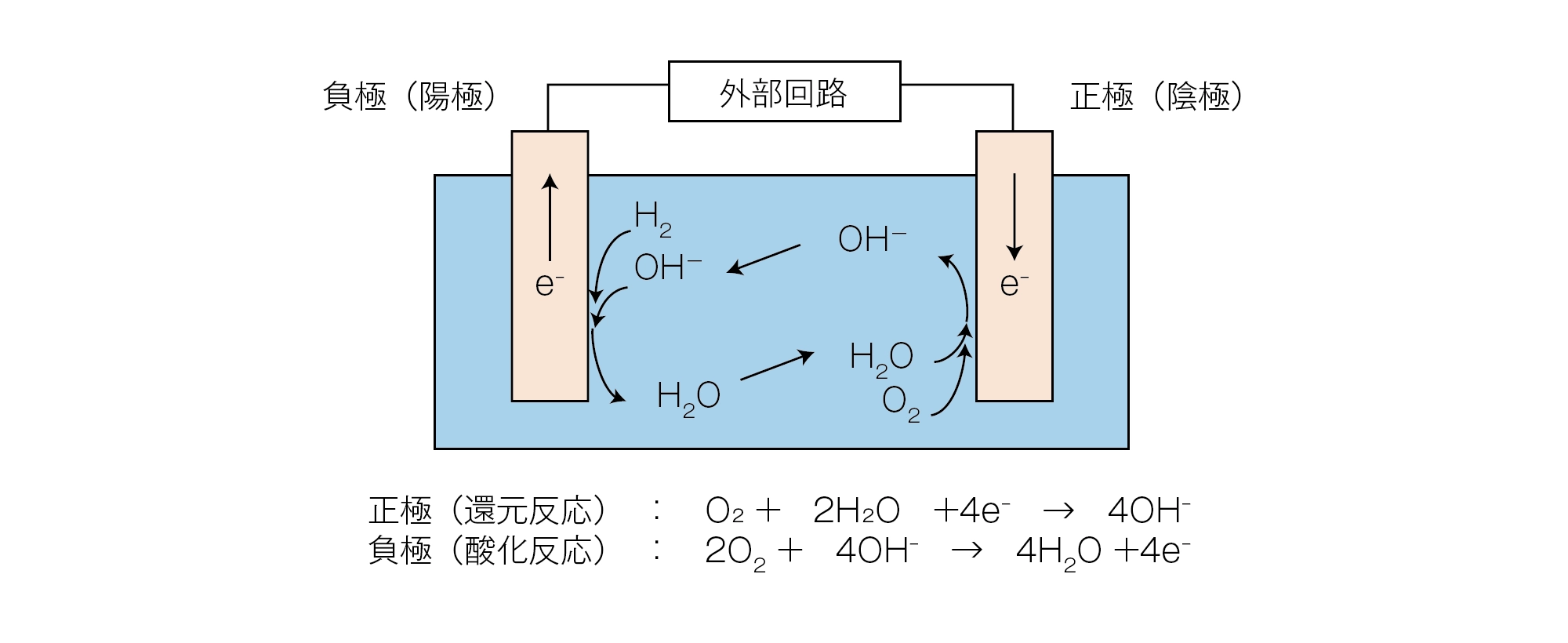
水の電気分解
この反応で発生した電子(e-)が、電気的に接続された外部回路を移動することによって、外部回路に電気的エネルギーを得ることができます。
この反応を全体反応として合わせると、下の反応式として表すことができます。
全体反応:O2 + 2H2 → 2H2O
これは、水素の燃焼反応の反応式(∗)と同じです。したがって、電池反応の場合も、水素と酸素を使って、水ができるという点では、同じ酸化還元反応だということがわかります。
一方で、燃焼反応とは異なり、電池反応において、電子は外部回路を通って移動し、熱はほとんど発生しない(エネルギーとして損失しない)ため、電池は化学エネルギーを電気エネルギーに効率よく変換する装置であると言えるわけです。
このように、とてもシンプルな原理と、それゆえの電気デバイスとしてのエネルギー効率の良さが今も昔も長い間、電池(化学電池)が使われてきた理由とも言えますし、今後もそれは大きくは変わらないと見られています。
電池を構成する3要素
さらに電池を構成するキーマテリアルについて、掘り下げていきたいと思います。電池の性能を決める重要な要素として、正極活物質、負極活物質、電解質の3つがまず挙げられます。
正極活物質 :電池反応で電子を受け取る物質。一般には、酸化剤を使うことが多い。
例:O2、Ag2O、MnO2、...
負極活物質 :電池反応で電子を放出する物質。一般には、還元剤を使うことが多い。
例:H2、Zn、Li、...
電解質 :イオン伝導体(この中を、イオンが移動する)
アニオン(陰イオン):正極 → 負極
カチオン(陽イオン):負極 → 正極
例:酸性水溶液、アルカリ性水溶液、非水電解液
これらが反応する過程において、外部回路を流れる"電子"の移動のしやすさ は、電解液中を移動する"イオン"の移動のしやすさより非常に大きいことになります。イオンの移動速度を担う大きな因子が電解液のイオン伝導度であり、これが外部回路(電子機器)への電流を制限する因子となっています。これが一般には、電池の内部抵抗と呼ばれ、電池の性能を表すおもな指標のひとつです。
つまり、電子機器で使われるには、この電解液を含む電池内部の抵抗を下げることが技術的に重要です。その理由において、電解質を水や有機溶媒に溶かした電解液を用いた電池が広く使われてきたわけです。近年では、固体状態であっても液体電解質なみに高いイオン電導度を示す固体電解質材料が発見されてきたことにより、固体電解質電池(全固体電池)の技術革新が起こりつつあり、非常に注目されている技術的背景です。
電池電圧はどのように決まるか
世の中で使われている電池には様々あり、その電気的性能も様々です。例えば、電池電圧の違いは、その正極、負極に使用される材料(活物質)に由来し、さまざまな種類の電池をつくることが可能です。
電池の反応の起源は、酸化還元反応であると説明しましたが、それぞれの物質の酸化力、還元力には強弱があり、その強さの順番は、標準電極電位で説明されます。
例として、標準水素電極(SHE)の電極電位を0Vとした場合、酸化銀電池では、正極が酸化銀(Ag2O)、負極が亜鉛(Zn)ですから、(+0.80V) - (-0.76V) = +1.56V の電池電位を示すことがわかります。
このように、電池の電圧は、正極・負極活物質の選択により決まるため、電池の種類(活物質の種類)を変えることでしか、電池電圧を変えることができません。携帯機器に使われることの多い、リチウムイオン電池も、4V付近のイメージがありますが、異なる活物質が採用された異なる電圧の電池が使い分けられています。
電池の電圧:使用する正極活物質と負極活物質の種類と組み合わせによって決まる
表に主な活物質の例を示します(いずれも理論値であり、実際の電池の電圧は異なります)。
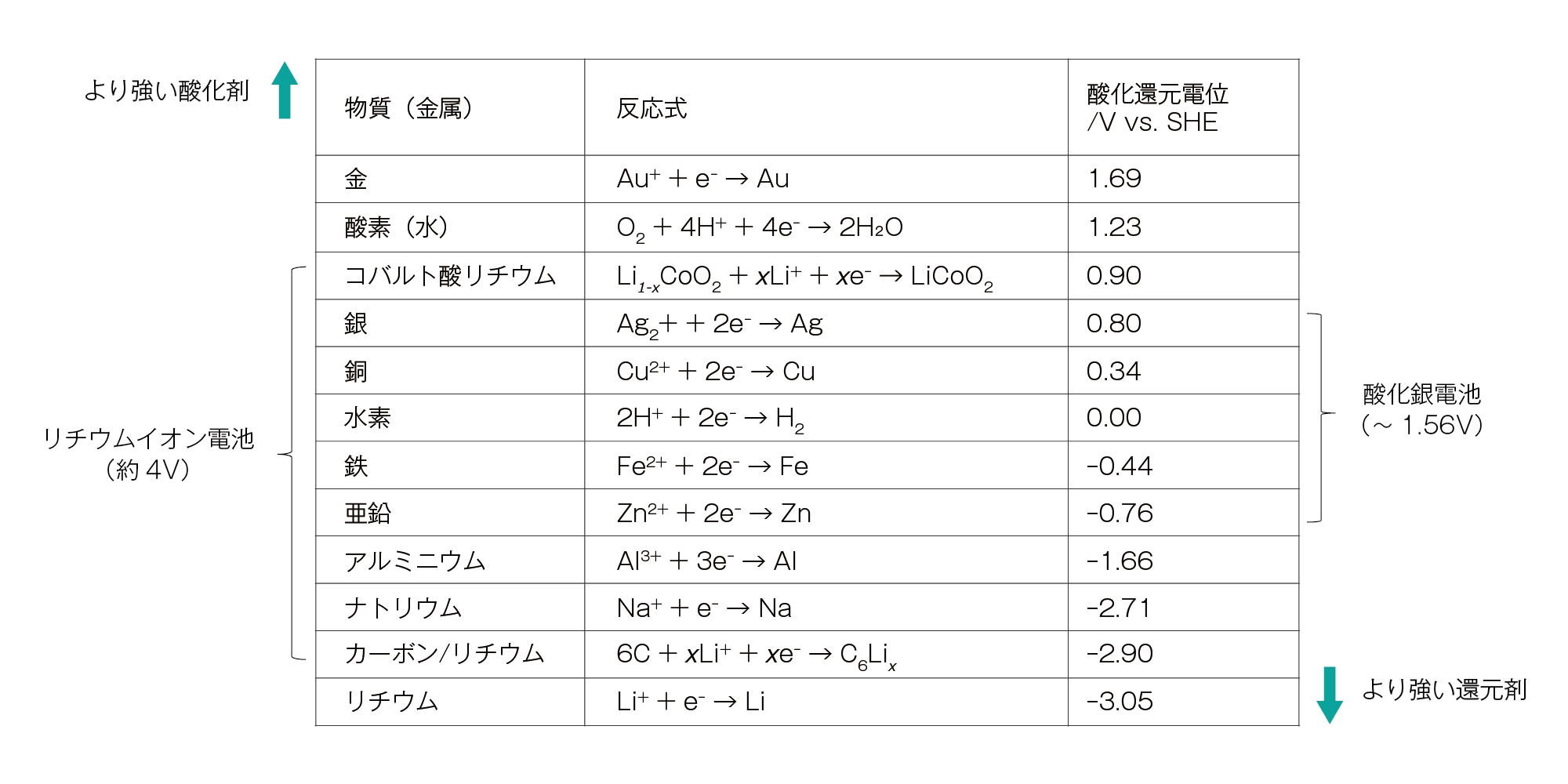
主な活物質の酸化還元電位
電池の放電カーブを決める要因
それでは、電池の放電カーブのかたち(放電に伴う電池電圧の変化)は、何に由来するのでしょうか。それは、電池に採用する活物質の反応の仕方の違いです。活物質とは、電池の正極負極に用いられる、それ自体が酸化還元を担う物質のことを言います。例えば、酸化銀電池では、正極活物質として酸化銀、負極活物質として亜鉛が使われています。
電池の放電カーブ:正極・負極活物質の反応の仕方により、放電カーブの形状が変わる
これら活物質の反応は、(1)均一反応、(2)不均一反応 に分けられます。
均一反応では、放電するとともに、活物質 の状態が均一的に変化していくことで、次第に電圧が低下していきます。つまり、(1)のように、放電カーブがなだらかに低下していく挙動となります。一方で、不均一反応では、放電に伴い、その活物質は放電済みの部分と未放電の部分に分かれ、二種の相の共存下で反応が進行します。そのように不均一に反応が進むことになり、放電カーブは(2)のように、平坦な挙動を示すことになります。
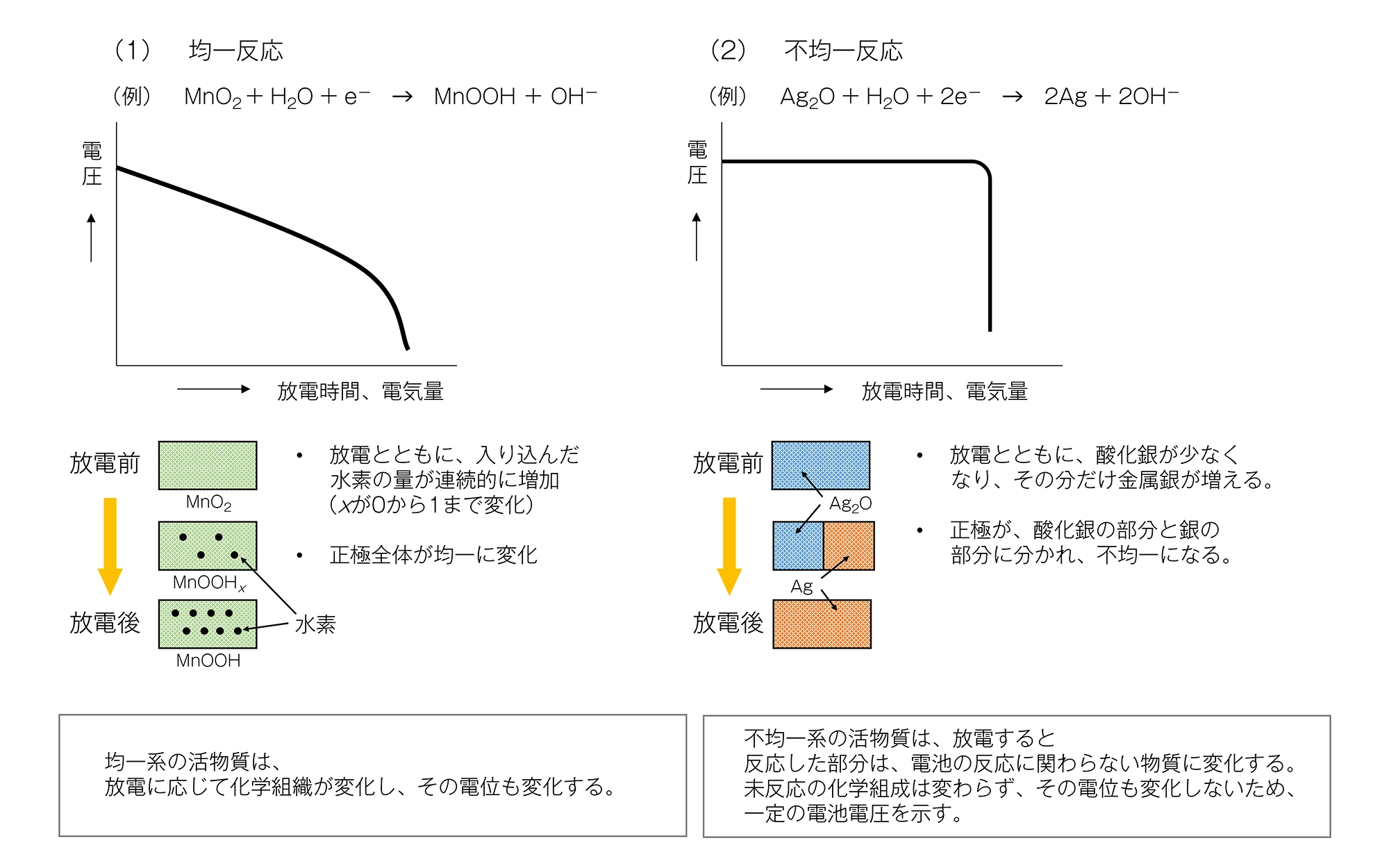
均一反応と不均一反応
電池を使用する電子機器の視点に立つと、(1)のような放電カーブでは、放電するほど電池電圧が下がることを利用して、電池の残量検知に活用することが可能です。一方で、(2)のような平坦な放電カーブでは、初期から使用末期まで電圧が大きく変わらないため、その駆動に一定の電圧が必要な機器においては大きなメリットとなります。たとえば、初期のクオーツウォッチでは、電池の電圧が時計の精度に影響することが多く、不均一反応由来の平坦な電圧カーブを持つ酸化銀電池(SR電池)が主に使われました。主にはこれらの反応の仕方に由来しますが、その他の物質のもつ特徴によっても、放電カーブが変わることがあります。
進化し続ける電池
以上の通り、電池技術の起源は古いものですが、材料の組み合わせによってさまざまな可能性を持っており、リチウムイオン電池や全固体電池など、技術開発がいまも活発にされています。マクセルではその幅広いラインアップと長年の技術蓄積、新たな技術革新により、これからもお客様のニーズに応え続けます。
関連製品
電池製品に関するお問合せフォーム
電池製品の選定、サンプルのご相談など、お問い合わせをお待ちしております。
まずはお気軽にお問合せください。
« 前の記事


